(лат. Argentum)
Ag, химический элемент I группы периодической системы Менделеева, атомный номер 47, атомная масса 107,868; металл белого цвета, пластичный, хорошо полируется. В природе находится в виде смеси двух стабильных изотопов 107Ag и 109Ag; из радиоактивных изотопов практически важен 110Ag (T1/2 = 253 cym). С. было известно в глубокой древности (4-е тыс. до н. э.) в Египте, Персии, Китае.
Распространение в природе. Среднее содержание С. в земной коре (кларк) 7·10
-6\% по массе. Встречается преимущественно в средне- и низкотемпературных гидротермальных месторождениях (См.
Гидротермальные месторождения), в зоне обогащения сульфидных месторождений, изредка - в осадочных породах (среди песчаников, содержащих углистое вещество) и россыпях (см.
Серебряные руды,
Серебро самородное). Известно свыше 50 минералов С. В биосфере С. в основном рассеивается, в морской воде его содержание 3·10
-8\%. С. - один из наиболее дефицитных элементов.
Физические и химические свойства. С. имеет гранецентрированную кубическую решётку (а = 4,0772 Å при 20 "С). Атомный радиус 1,44 Å, ионный радиус Ag+ 1,13 Å. Плотность при 20 °С 10,5 г/см3, tпл 960,8°С; tkип 2212°С; теплота плавления 105 кдж/кг (25,1 кал/г). С. обладает наивысшими среди металлов удельной электропроводностью 6297 сим/м (62,97 ом-1(см-1) при 25 °С, теплопроводностью 407,79 вт/(м·К) [0,974 кал/(см·°С·сек)] при 18 °С и отражательной способностью 90-99\% (при длинах волн 100000-5000 Å). Удельная теплоёмкость 234,46 дж/(кг·К) [0,056 кал/(г ·°С)], удельное электросопротивление 15,9 ном (м (1,59 мком (см) при 20°С. С. диамагнитно с атомной магнитной восприимчивостью при комнатной температуре - 21,56·10-6, модуль упругости 76480 Мн/м2 (7648 кгс/мм2), предел прочности 100 Мн/м2 (10 кгс/мм2), твёрдость по Бринеллю 250 Мн/м2 (25 кгс/мм2). Конфигурация внешних электронов атома Ag 4d105s4.
С. проявляет химические свойства, характерные для элементов 16 подгруппы периодической системы Менделеева. В соединениях обычно одновалентно.
С. находится в конце электрохимического ряда напряжений, его нормальный электродный потенциал Ag ⇔ Ag+ + е- равен 0,7978 в.
При обычной температуре Ag не взаимодействует с O2, N2 и H2. При действии свободных галогенов и серы на поверхности С. образуется защитная плёнка малорастворимых галогенидов и сульфида Ag2S (кристаллы серо-чёрного цвета). Под влиянием сероводорода H2S, находящегося в атмосфере, на поверхности серебряных изделий образуется Ag2S в виде тонкой плёнки, чем объясняется потемнение этих изделий. Сульфид можно получить действием сероводорода на растворимые соли С. или на водные суспензии его солей. Растворимость Ag2S в воде 2,48·10-5моль/л (25 °С). Известны аналогичные соединения - селенид Ag2Se и теллурид Ag2Te.
Из окислов С. устойчивыми являются закись Ag2O и окись AgO. Закись образуется на поверхности С. в виде тонкой плёнки в результате адсорбции кислорода, которая увеличивается с повышением температуры и давления.
Ag2O получают действием КОН на раствор AgNO3. Растворимость Ag2O в воде - 0,0174 г/л. Суспензия Ag2O обладает антисептическими свойствами. При 200 °С закись С. разлагается. Водород, окись углерода, многие металлы восстанавливают Ag2O до металлического Ag. Озон окисляет Ag2O с образованием AgO. При 100 °С AgO разлагается на элементы со взрывом. С. растворяется в азотной кислоте при комнатной температуре с образованием AgNO3. Горячая концентрированная серная кислота растворяет С. с образованием сульфата Ag2SO4 (растворимость сульфата в воде 0,79\% по массе при 20 °С). В царской водке С. не растворяется из-за образования защитной плёнки AgCI. В отсутствие окислителей при обычной температуре HCI, HBr, HI не взаимодействуют с С. благодаря образованию на поверхности металла защитной плёнки малорастворимых галогенидов. Большинство солей С., кроме AgNO3, AgF, AgCIO4 обладают малой растворимостью. С. образует комплексные соединения, большей частью растворимые в воде. Многие из них имеют практическое значение в химической технологии и аналитической химии, например комплексные ионы [Ag (CN)2]-, [Ag (NH3)2]+, [Ag (SCN)2]-.
Получение. Большая часть С. (около 80\%) извлекается попутно из полиметаллических руд, а также из руд золота и меди. При извлечении С. из серебряных и золотых руд применяют метод цианирования (См.
Цианирование) - растворения С. в щелочном растворе цианида натрия при доступе воздуха:
2 Ag + 4 Na CN + 1/2О2 + H2O = 2 Na [Ag (CN)2] + 2NaOH.
Из полученных растворов комплексных цианидов С. выделяют восстановлением цинком или алюминием:
2 [Ag (CN)2]- + Zn = [Zn (CN)4]2- +2 Ag.
Из медных руд С. выплавляют вместе с черновой медью и затем выделяют его из анодного шлама, образующегося при электролитической очистке меди. При переработке свинцово-цинковых руд С. концентрируется в сплавах свинца - черновом свинце, из которого его извлекают добавлением металлического цинка, образующего с С. нерастворимое в свинце тугоплавкое соединение Ag2Zn3, всплывающее на поверхность свинца в виде легко снимающейся пены. Далее для отделения С. от цинка последний отгоняют при 1250 °С. Извлечённое из медных или свинцово-цинковых руд С. сплавляют (сплав Доре) и подвергают электролитической очистке.
Применение. С. используют преимущественно в виде сплавов: из них чеканят монеты, изготовляют бытовые изделия, лабораторную и столовую посуду. С. покрывают радиодетали для придания им лучшей электропроводности и коррозионной стойкости; в электротехнической промышленности применяются серебряные контакты (см.
Контакт электрический). Для пайки титана и его сплавов используются серебряные припои; в вакуумной технике С. служит конструкционным материалом Металлическое С. идёт на изготовление электродов для серебряно-цинковых и серебряно-кадмиевых аккумуляторов. Оно служит катализатором (См.
Катализаторы) в неорганическом и органическом синтезе (например, в процессах окисления спиртов в альдегиды и кислоты, а также этилена в окись этилена). В пищевой промышленности применяются серебряные аппараты, в которых приготовляют фруктовые соки (см. также
Серебрение). Ионы С. в малых концентрациях стерилизуют воду. Огромные количества соединений С. (AgBr, AgCI, Agl) применяются для производства кино- и фотоматериалов (см.
Серебра галогениды,
Серебра нитрат).
С. И. Гинзбург.
Серебро в искусстве. Благодаря красивому белому цвету и податливости в обработке С. с глубокой древности широко используется в искусстве. Однако чистое С. слишком мягко, поэтому при изготовлении монет и различных художественных произведений в него добавляют цветные металлы, чаще всего медь. Средствами обработки С. и украшения изделий из него служат чеканка, литьё, филигрань, тиснение, применение эмалей, черни, гравировки, золочения.
Высокая культура художественной обработки С. характерна для искусства эллинистического мира, Древнего Рима, Древнего Ирана (сосуды эпохи Сасанидов, 3-7 вв.), средневековой Европы. Разнообразием форм, выразительностью силуэтов, мастерством фигурной и орнаментальной чеканки и литья отличаются изделия из С., созданные мастерами Возрождения и барокко (Б. Челлини в Италии, ювелиры из семейств Ямницеров, Ленкеров, Ламбрехтов и другие в Германии). В 18 - начале 19 вв. ведущая роль в производстве изделий из серебра переходит к Франции (К. Баллен, Т. Жермен, Р. Ж. Огюст и др.). В искусстве 19-20 вв. преобладает мода на незолочёное
серебро; среди технических приёмов доминирующее положение занимает литьё, распространяются машинные приёмы обработки. В русском искусстве 19 - начала 20 вв. выделяются изделия фирм Грачевых, П. А. Овчинникова, П. Ф. Сазикова, П. К. Фаберже, И. П. Хлебникова. Творческое развитие традиций ювелирного искусства прошлого, стремление наиболее полно выявить декоративные качества С. характерны для сов. изделий из С., среди которых видное место занимают произведения народных мастеров (см.
Великоустюжское чернение по серебру Кубани (См.
Кубань)).
Г. А. Маркова.
Серебро в организме. С. - постоянная составная часть растений и животных. Его содержание составляет в среднем в морских растениях 0,025
мг на 100
г сухого вещества, в наземных - 0,006
мг; в морских животных - 0,3-1,1
мг, в наземных - следовые количества (10
-2-10
-4 мг). У животных накапливается в некоторых эндокринных железах, пигментной оболочке глаза, в эритроцитах; выводится главным образом с фекалиями. С. в организме образует комплексы с белками (глобулинами крови, гемоглобином и др.). Блокируя
Сульфгидрильные группы, участвующие в формировании активного центра ферментов, С. вызывает ингибирование последних, в частности инактивирует аденозинтрифосфатазную активность
Миозина. Биологическая роль С. изучена недостаточно. При парентеральном введении С. фиксируется в зонах воспаления; в крови связывается преимущественно глобулинами сыворотки.
Ю. И. Раецкая.
Препараты С. обладают антибактериальным, вяжущим и прижигающим действием, что связано с их способностью нарушать ферментные системы микроорганизмов и осаждать белки. В медицинской практике наиболее часто применяют
Серебра нитрат,
Колларгол, протаргол (в тех же случаях, что и колларгол); бактерицидную бумагу (пористая бумага, пропитанная нитратом и хлоридом С.) применяют при небольших ранах, ссадинах, ожогах и т. п.
Экономическое значение. С. в условиях товарного производства выполняло функцию всеобщего эквивалента наряду с
Золотом и приобрело, как и последнее, особую потребительную стоимость - стало деньгами (См.
Деньги). "Золото и
серебро по своей природе не деньги, но деньги по своей природе - золото и
серебро" (Маркс К., в кн.: Маркс К. и Энгельс Ф., Соч., 2 изд., т. 13, с. 137). Товарный мир выделил С. в качестве денег потому, что оно обладает важными для денежных товаров свойствами: однородностью, делимостью, сохраняемостью, портативностью (высокой стоимостью при небольших объёме и массе), легко поддаётся обработке.
Первоначально С. обращалось в форме слитков. В странах Древнего Востока (Ассирия, Вавилон, Египет), а также в Греции и Риме С. было широко распространённым денежным металлом наряду с золотом и медью. В Древнем Риме чеканка монет из С. начата в 4-3 вв. до н. э. Чеканка первых древнерусских монет из С. началась в 9-10 вв.
В период раннего средневековья преобладала чеканка золотой монеты. С 16 в. в связи с недостатком золота, расширением добычи С. в Европе и притоком его из Америки (Перу и Мексики) С. стало основным денежным металлом в странах Европы. В эпоху первоначального накопления капитала почти во всех странах существовал серебряный
Монометаллизм или
Биметаллизм. Золотые и серебряные монеты обращались по действительной стоимости содержавшегося в них благородного металла, причём ценностное соотношение между этими металлами складывалось стихийно, под влиянием рыночных факторов. В конце 18 - начале 19 вв. на смену системе параллельной валюты пришла система двойной валюты при которой государство в законодательном порядке устанавливало обязательное соотношение между золотом и С. Однако эта система оказалась чрезвычайно неустойчивой, т. к. в условиях стихийного действия закона стоимости неизбежно возникало несоответствие между рыночными и фиксированными стоимостями золота и С. (см. "
Грешема закон"). В конце 19 в. стоимость С. резко снизилась вследствие совершенствования способов его добычи из полиметаллических руд (в 70-80-е гг. 19 в. отношение стоимости золота к С. составляло 1:15-1: 16, в начале 20 в. уже 1: 38-1: 39). Рост мировой добычи золота ускорил процесс вытеснения обесценившегося С. из обращения. В последней четверти 19 в. широкое распространение в капиталистическом мире получил золотой монометаллизм. В большинстве стран мира вытеснение серебряной валюты золотой закончилось в начале 20 в. Серебряная валюта сохранилась примерно до середины 30-х гг. 20 в. в ряде стран Востока (Китай, Иран, Афганистан и др.). С отходом этих стран от серебряного монометаллизма С. окончательно утратило значение валютного металла. В промышленно развитых капиталистических странах С. используется только для чеканки разменной монеты.
Рост использования С. в технических целях, в зубоврачебном деле, в медицине, а также в производстве ювелирных изделий после 2-й мировой войны 1939-45 в условиях отставания добычи С. от потребностей рынка вызвал его нехватку. До войны около 75\% добываемого С. ежегодно использовалось для монетарных целей. В 1950-65 этот показатель снизился в среднем до 50\%, а в последующие годы продолжал снижаться, составив в 1971 всего 5\%. Многие страны перешли к использованию в качестве монетарного материала медно-никелевых сплавов. Хотя серебряные монеты всё ещё находятся в обращении, чеканка новых монет из С. во многих странах запрещена, а в некоторых значительно уменьшено его содержание в монетах. В США, например, согласно закону о чеканке монет, принятому в 1965, около 90\% С., которое шло раньше для чеканки монет, выделено для др. целей. Содержание С. в 50-центовой монете снижено с 90 до 40\%, а монеты достоинством в 10 и 25 центов, содержавшие ранее 90\% С., чеканятся без примесей С. Новые монеты из С. чеканятся в связи с различными памятными событиями (Олимпийскими играми, юбилеями, мемориалами и т. д.).
В начале 70-х гг. основными потребителями С. были следующие отрасли: производство ювелирных изделий (столового С. и анодированных изделий), электротехническая и электронная промышленность, кинофотопромышленность.
Для рынка С. в 60-х и начале 70-х гг. характерен рост цен на С. и систематическое превышение потребления С. над производством первичного металла (см.
Серебряные руды). Дефицит восполнялся в значительной мере за счёт вторичного металла, в частности полученного в результате переплавки монет.
Л. М. Райцин.
Лит.: Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963; Плаксин И. Н., Металлургия благородных металлов, М., 1958; Краткая химическая энциклопедия, т. 4, М., 1965; Максимов М. М., Очерк о серебре, М., 1974; Постникова-Лосева М. М., Русское ювелирное искусство, его центры и мастера, М., 1974; Link E. М., Eine Kunst-und Kulturgeschich-te des Silbers, B. - Fr./M. - W., 1968.
Серебро. Амфора древнегреческой работы из Чертомлыкского кургана (Днепропетровская область, УССР). 4 в. до н. э. Эрмитаж. Ленинград.
Серебро. Блюдо (Аугсбург, Германия). 1-я пол. 17 в. Оружейная палата. Москва.
Серебро. Ахеменидский ритон (Древний Иран). 5 в. до н. э. Британский музей. Лондон.
Серебро. Сасанидское блюдо (Древний Иран). 4 в. н. э. Эрмитаж. Ленинград.
Серебро. Звёздчатый колт из Тульского клада. 12 в. Оружейная палата. Москва.
Серебро. Братина московской работы. 1-я пол. 17 в. Оружейная палата. Москва.
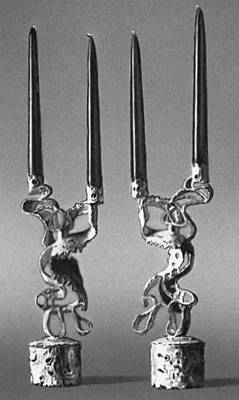
Серебро. Ф. Каннилла (Италия). Подсвечники. Около 1960. Частное собрание. Италия.
Серебро. Х. К. ван де Велде (Бельгия). Кофейный сервиз. 1922. Музей художественных ремёсел. Цюрих.
Серебро. Г. М. Магомедов (Кубачи, Дагестанская АССР). Декоративная ваза. 1967. Научно-исследовательский институт художественной промышленности. Москва.








.jpg?width=120)

.jpg?width=200)

![Евровидении-2007]]» Евровидении-2007]]»](https://commons.wikimedia.org/wiki/Special:FilePath/ESC 2007 Russia - Serebro - Song No 1.jpg?width=200)
![Serebro на обложке ''[[Billboard]]'' Serebro на обложке ''[[Billboard]]''](https://commons.wikimedia.org/wiki/Special:FilePath/Russbillboard 1554427a.png?width=200)





![Древнеегипетское]] судно; 1479-1425 гг. {{донэ}}; 19,5 × 13 см; [[Метрополитен-музей]] (Нью-Йорк) Древнеегипетское]] судно; 1479-1425 гг. {{донэ}}; 19,5 × 13 см; [[Метрополитен-музей]] (Нью-Йорк)](https://commons.wikimedia.org/wiki/Special:FilePath/Libation Vessel of Manuwai MET EG118.jpg?width=200)
![Древнегреческая]] [[тетрадрахма]]; 315–308 гг. {{донэ}}; диаметр: 2,7 см; Метрополитен-музей Древнегреческая]] [[тетрадрахма]]; 315–308 гг. {{донэ}}; диаметр: 2,7 см; Метрополитен-музей](https://commons.wikimedia.org/wiki/Special:FilePath/Silver tetradrachm MET DP139641.jpg?width=200)

![Римская]] тарелка; 1–2 века н. э .; высота: 0,1 см, диаметр: 12,7 см; Метрополитен-музей Римская]] тарелка; 1–2 века н. э .; высота: 0,1 см, диаметр: 12,7 см; Метрополитен-музей](https://commons.wikimedia.org/wiki/Special:FilePath/Silver plate MET DP231273.jpg?width=200)
![Римский бюст [[Серапис]]; 2 век; 15,6 х 9,5 см; Метрополитен-музей Римский бюст [[Серапис]]; 2 век; 15,6 х 9,5 см; Метрополитен-музей](https://commons.wikimedia.org/wiki/Special:FilePath/Silver bust of Serapis MET DT6658.jpg?width=200)
![Супница французская [[рококо]]; 1749; высота: 26,3 см, ширина: 39 см, глубина: 24 см; Метрополитен-музей Супница французская [[рококо]]; 1749; высота: 26,3 см, ширина: 39 см, глубина: 24 см; Метрополитен-музей](https://commons.wikimedia.org/wiki/Special:FilePath/Silver Tureen (a), lid (b) -pair with 1975.1.2560a-c- MET SLP2561a b-1.jpg?width=200)
,.jpg?width=200)
![неоклассический]] кувшин; 1784-1785; высота: 32,9 см; Метрополитен-музей неоклассический]] кувшин; 1784-1785; высота: 32,9 см; Метрополитен-музей](https://commons.wikimedia.org/wiki/Special:FilePath/Ewer MET DT236853.jpg?width=200)
![штат Огайо]], США) штат Огайо]], США)](https://commons.wikimedia.org/wiki/Special:FilePath/Elkington & Co. - Neo-Rococo Coffee Pot - 2003.243 - Cleveland Museum of Art.jpg?width=200)
![Французские десертные ложки в стиле [[модерн]]; около 1890 года; [[Смитсоновский музей дизайна Купер Хьюитт]] (Нью-Йорк) Французские десертные ложки в стиле [[модерн]]; около 1890 года; [[Смитсоновский музей дизайна Купер Хьюитт]] (Нью-Йорк)](https://commons.wikimedia.org/wiki/Special:FilePath/Dessert Spoon (France), ca. 1890 (CH 18653899-2).jpg?width=200)
, ca. 1905–10 (CH 18444035) (cropped).jpg?width=200)
![Зеркало в стиле модерн; 1906; длина: 20,7 см, вес: 88 г; [[Рейксмюсеум]] ([[Амстердам]], [[Нидерланды]]) Зеркало в стиле модерн; 1906; длина: 20,7 см, вес: 88 г; [[Рейксмюсеум]] ([[Амстердам]], [[Нидерланды]])](https://commons.wikimedia.org/wiki/Special:FilePath/Handspiegel met gedreven Jugendstilornament, BK-1967-10.jpg?width=200)
